
2019年7月22日,恒瑞医药PD-1药物卡瑞利珠单抗注射液(商品名:艾立妥)从位于苏州工业园的恒瑞全资子公司苏州盛迪亚生物医药有限公司首批出货。后者是恒瑞生物药品的中试和商业化生产基地,创立后首款上市药物即艾立妥。
作为国产第三款、国内第五款上市的PD-1单抗药物,从上市到定价,再到赠药方案发布,艾立妥受到的关注远不及信迪利单抗和特瑞普利单抗。
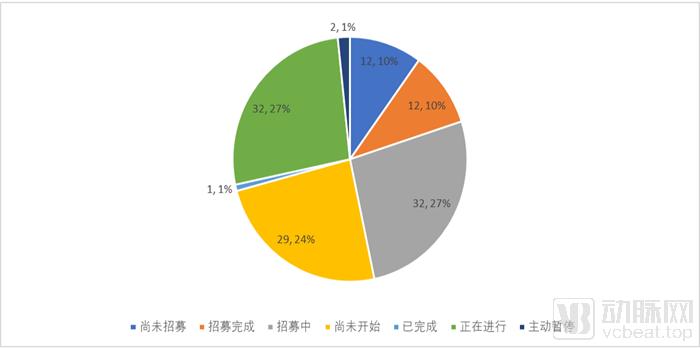
随着国产PD-1单抗药物上市,产业端对于这一明星靶点的热度急剧下降,一些计划进行的临床试验开始被搁置。根据中国临床试验数据库查询,尽管肇始于2016年的PD-1临床试验登记热一直持续到2019年,目前国内登记进行的PD-1相关临床试验共121起,其中正在进行的临床试验仅32起,占比不到三成,而超过七成临床试验停滞在患者招募环节。
简单观察前述PD-1临床试验的用药方式和适应症结构可以找出一些趋势信息。

从用药方式来看,联合用药逐渐成为主流趋势。PD-1单抗能够实现比传统药物更好的疗效,但由于对于患者本身状况要求严苛,能够从中获益的患者人数仅两成左右,通过与化疗、放疗等治疗方式联合发力,PD-1单抗的作用范围将扩大。相比找出PD-1单抗的优化路径,探索效益更佳的联合用药方案无疑是当前性价比最高的方式。
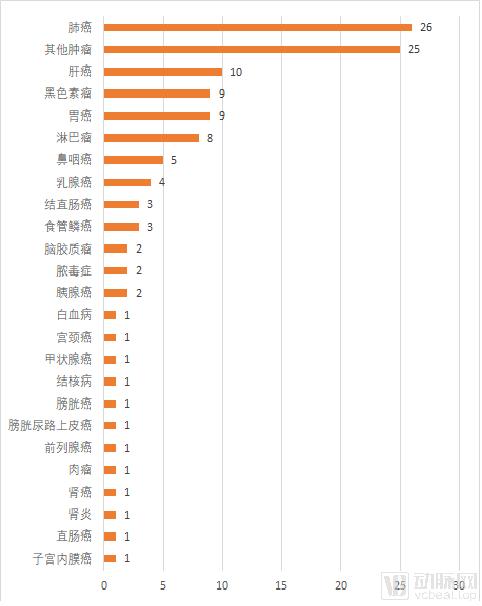
从登记临床试验的适应症来看,瘤种的聚集程度仍然相当高,肺癌和肝癌这两种高发癌种也是PD-1单抗新增适应症的热门方向。对于仍然希望在PD-1领域做出成绩的药企而言,热门新增适应症的速度比拼和多样化的新增适应症尝试确是很重要的两件事。
无论是尝试联合治疗方案还是新增适应症,都对PD-1单抗玩家的临床资源整理能力和资金实力提出了更高的要求。与君实生物依托苏州众合开展特瑞普利单抗的临床研究相似,恒瑞医药也单独设立盛迪亚生物作为PD-1单抗的主要开发基地。
被注入集团临床资源的生物制药子公司
盛迪亚生物于2015年9月注册成立,恒瑞医药计划总投资15亿元来建设这家承接其生物制药业务的子公司。盛迪亚生物在成立之初就获得来自母公司的首8亿元注资,引进世界先进水平的纯化、超滤、分析等设备及制剂自动化生产线,打造符合美国FDA和欧盟EMA质量认证的生产体系,立志建设国际水平的生物医药研发生产基地。
2017年4月,盛迪亚生物获得药品生产许可证。截止2018年底,恒瑞医药已陆续向盛迪亚生物投入约8.5亿元,初步完成一期60000平米厂房的建设,其中包括含有两条2000L单抗生产线的第一抗体车间和一个溶瘤病毒中试车间。
到2019年底,盛迪亚计划新建总计8套2000L规模细胞反应器的第二抗体车间,全部达产后细胞培养总规模可达24000L,预计产值过百亿。其中,有4套系统已经在今年一季度投入正常使用。
盛迪亚生物在卡瑞利珠单抗开发和审批的过程中扮演了重要角色。
从2015年1月,恒瑞医药提交当时被命名为注射用SHR-1210的艾立妥临床试验申请,到2017年6月,SHR-1210治疗复发或难治性经典型霍奇金淋巴瘤II期临床研究完成招募,再到2018年4月提交注射用艾立妥新药申请、2019年6月获准生产,盛迪亚生物一直是主导单位。
实际上,在艾立妥通过霍奇金淋巴瘤加速上市的同时,盛迪亚生物还开展了一系列针对多样化瘤种的单独和联合用药临床试验。
2015年4月,SHR-1210对晚期黑色素瘤患者和晚期实体瘤患者的I期临床试验同步完成招募。此外,恒瑞在当年10月开始了SHR-1210联合阿帕替尼治疗晚期胃癌和肝细胞癌的探索性临床试验。同时完成招募的还有SHR-1210在既往经过治疗的晚期肝细胞癌患者的II/III期临床试验。
2017年3月,PD-1抗体联合阿帕替尼治疗晚期非小细胞肺癌的II期研究启动。次月,PD-1抗体联合阿帕替尼或化疗治疗晚期肝癌II期研究启动;5月,SHR-1210治疗非小细胞肺癌患者的II期临床试验启动;同月,SHR-1210对照研究者选择化疗治疗晚期食管癌的III期临床研究和SHR-1210联合化疗一线治疗晚期非小细胞肺癌患者的III期临床研究完成招募。
次月,SHR-1210联合放疗治疗局部晚期食管鳞癌的单臂探索性研究启动。
2018年3月,SHR-1210联合阿帕替尼治疗晚期肝细胞癌Ⅱ期临床试验启动;次月,PD-1抗体SHR-1210治疗胃癌或胃食管交界处癌临床研究和SHR1210联合艾坦治疗小细胞肺癌的II期临床试验完成招募。8月,评价PD-1抗体治疗鼻咽癌患者的有效性和安全性研究的临床II期启动。
作为国内创新药的龙头,恒瑞医药以化学制剂龙头身份切入生物制药的领域,具有双重优势。一方面,恒瑞医药的管道布局覆盖肿瘤免疫治疗、化疗和小分子药物,聚焦高发的肿瘤大品种领域,包括肝癌、NSCLC、食管癌、霍奇金淋巴瘤、胃癌、肺癌等等。
另一方面,借助本身化学制剂的研产优势,恒瑞医药在联合用药的角度拥有国内一众巨头无法比拟的根基,结合公司本身一流的商业化拓展队伍,恒瑞医药确是国内肿瘤免疫治疗领域的领头羊,不过联合用药的副作用则是恒瑞医药的弱势。
在围绕PD-1单抗SHR-1210展开的多达15项临床试验中,联合用药的项目(包括联合化疗、联合放疗、联合阿帕替尼、联合MEK激酶抑制剂)有7项之多,其中在与Incyte的联合临床试验中曾发生血管瘤副作用,因此在临床数据上恒瑞医药仍需要进一步评估。
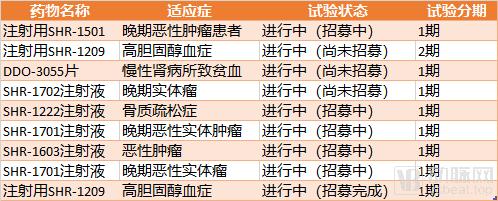
工商注册资料显示,盛迪亚的生产范围为治疗用生物制品,包括贝伐珠单抗注射液、注射用卡瑞利珠单抗注射液、SHR-1316注射液。除卡瑞利珠单抗外,还承担恒瑞内部主要自主创新的生物药品及生物类似药品的研发、中试放大和商业化生产。其中,盛迪亚生物研发的生物类似药贝伐珠单抗已进入临床III期研究,预计2020年可上市销售。
产品管线多样化
动脉网查询后发现,盛迪亚生物独立或者依托恒瑞医药资源开展了大量研发创新活动。
2015年9月,公司将具有自主知识产权的用于肿瘤免疫治疗的PD-1生物创新药国外权益许可给美国Incyte制药公司,首次实现了中国企业从进口美国生物医药技术向出口创新技术的转变。
2016年,公司成功引进了日本Oncolys BioPharma公司的溶瘤腺病毒产品,补充公司肿瘤免疫产品线,增强公司在抗肿瘤领域的竞争力。同时,公司加快创新药的海外临床进度,目前PD-L1创新药分别已在美国及澳大利亚开展临床研究,将最终实现创新药的海外销售。
在研发管线多样化方面,盛迪亚生物已经做了多种尝试。
依托恒瑞医药的资金、技术和人才支持,公司建设并完善了商业化生产与工艺研发团队,聘用各层次专业技术人才,博士、硕士、海归等高新技术人才比重超过80%。同时,公司注重研发投入,2018研发投入比2017年上涨300%,苏州盛迪亚与上海恒瑞分工协作、加大研发投入,加快创新研发速度与产业化进程,在PD-1的下半场竞争中形成了自己独特的优势。

